
细胞涂片,通常需要固定和染色以便进行细胞鉴定和计数。更具体的可以分为血细胞系涂片和脱落细胞涂片两大类。常用的染色方法有罗氏、巴氏和苏木素-伊红(HE)法三种。

罗氏染色液包含瑞氏、姬姆萨、瑞氏姬姆萨、迪夫染色液四种,在血细胞系涂片中广泛应用。巴氏染色液包含EA36、EA50、EA65三种,用于不同脱落细胞涂片的染色。HE法为使用比较广泛的常规染色法。
上述产品在应用到不同的细胞涂片时,各有所长,较为常用的是罗氏的姬姆萨染色。由于涂片样本载体各有不同,染色的观察重点也不同,因此相应的涂片处理和染色步骤在实际应用中都会基于标准步骤略有调整,以达到较为符合实验需求的显示效果。
标准步骤
新鲜全血或者抗凝血的染色步骤通常会作为血细胞系相关染色产品的标准步骤。通常为:
1、取5-10ul样本,推片;
2、室温晾干贴片;
3、使用甲醇或乙醇固定后染色亦或者直接使用含固定成分的染色液进行染色;
4、添加缓冲液稀释染色液并辅助定色;
5、切片晾干后观察。

调整方法
各种提取后重悬的细胞样本大多需要对前三步的贴片固定步骤进行调整,这里提供几种常用的调整方法:
1
针对成分复杂的淋巴细胞分离液提取样本适当离心后,使用1×PBS重悬细胞避免混悬液成分对细胞染色产生影响,如背景着色、成膜影响细胞观察。

2
1×PBS、细胞灌洗液以及骨髓冲洗液等相比于全血而言都比较稀,难以涂布成稳定形态,而且晾干产生的盐析也会对细胞形态产生影响。因此大多使用加醇(5ul样本加10ul乙醇或甲醇)辅助展片晾干或预固定(5ul样本加5ul 10%中性福尔马林固定液或4%多聚甲醛固定液,固定10-20min)后,画圈涂片再晾干的形式来制备涂片。
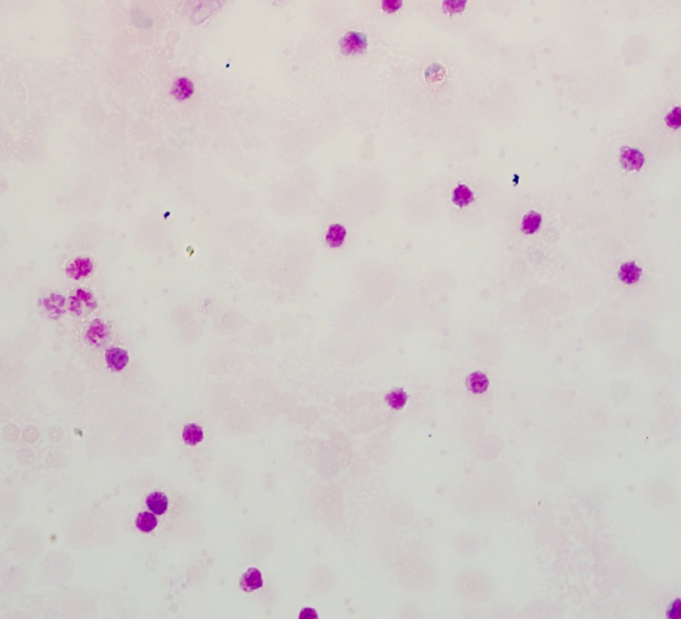
3
需要同时保障胞核和胞质的着色,在有核血细胞计数或肿瘤细胞计数过程中颜色对比并不够清晰,可以通过对第四步稀释液的种类进行更换的形式来强化对核着色和嗜多色红细胞的显示。如:使用1×PBS pH 7.2-7.4替代试剂盒内稀释液或自行购置的pH 6.4-6.8稀释液进行染色后稀释和定色可以洗脱胞质嗜酸性着色,增强胞核的嗜碱性着色。但是,如需保留红细胞着色就要严格控制稀释液的使用。
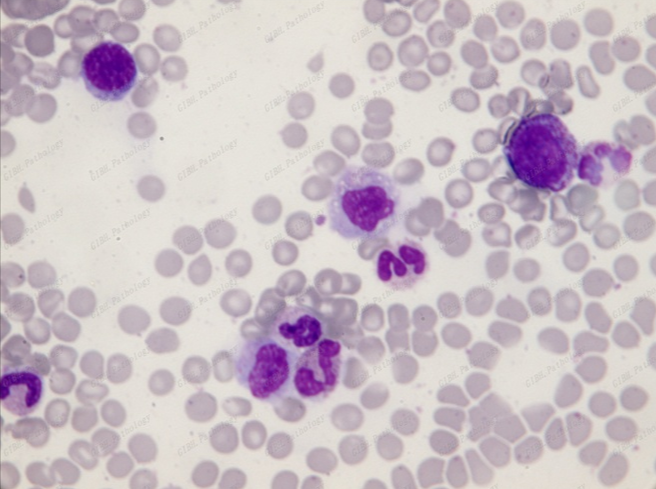
4
通常细胞涂片建议直接晾干镜检,不建议长期保存。但如需短期保存1周-2个月亦可晾干后使用中性树胶进行封片保存。
系列产品


